TFOS DEWS II - Schmerz und Empfindung
Carlos Belmonte, MD, PhD1, , Jason J. Nichols, OD, PhD1, Stephanie M. Cox, OD, James A. Brock, D.Phil, Carolyn G. Begley, OD, MS, David A. Bereiter, PhD, Darlene A. Dartt, PhD, Anat Galor, MD, Pedram Hamrah, MD, Jason J. Ivanusic, PhD, Deborah S. Jacobs, MD, Nancy A. McNamara, OD, PhD, Mark I. Rosenblatt, MD, PhD, Fiona Stapleton, MCOptom, PhD, James S. Wolffsohn, FCOptom, PhD
German translation sponsored by Allergan
Wie vom TFOS DEWS II Unterausschuss für Schmerz und Empfindung angegeben, können Schmerzen in eine nozizeptive und neuropathische Form unterschieden werden. Nozizeptive Schmerzen treten als Reaktion auf eine tatsächliche oder drohende Gewebeschädigung auf. Neuropathische Schmerzen treten jedoch aufgrund einer Läsion innerhalb des somatosensorischen Nervensystems auf und werden üblicherweise als pathologische Schmerzen oder Schmerzen ohne biologischen Wert bezeichnet.
Mit dem Trockenen Auge assoziierte Schmerzen werden über die peripheren Axone der Neuronen des Ganglion trigeminale (TG) übertragen, die die Hornhaut und die Bindehaut innervieren. Innerhalb des Hornhautstromas bilden sie einen subepithelialen Nervenplexus, dessen aufsteigende Fasern sich ausgiebig verzweigen und innerhalb der oberflächlichen Epithelschichten enden. Funktionell zählen sensorische Nerven zu den polymodalen Nozizeptorneuronen, zu den reinen Mechanonozizeptorneuronen und zu den Kälte-Thermorezeptorneuronen. Polymodale Nozizeptoren sind Die mukös-wässrige Schicht liegt den apikalen Epithelzellen und deren kohlehydratreicher Glykokalix auf. In gewonnener Tränenflüssigkeit von Patienten mit Trockenem Auge wurden Veränderungen der Muzinmenge oder der Glykosylierung verschiedener Bestandteile berichtet. Die mukös-wässrige Phase enthält mindestens vier bedeutende Muzine und über 1.500 verschiedene Proteine und Peptide. Es wurde berichtet, dass sich die Tränenflüssigkeit von Patienten mit Trockenem Auge bezüglich der Proteine des Tränenfilms unterscheidet, aber bislang wurde kein definitives Proteinset oder ein Grad der Veränderung der Proteine validiert, um in der Diagnose Anwendung zu finden. Dies ist ein Gebiet, dem mehr Aufmerksamkeit gewidmet werden sollte.
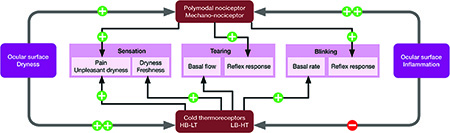
Abb. 4. Diagramm mit Zusammenfassung, wie Augenentzündungen verschiedener Ätiologien oder die Austrocknung der Augenoberfläche beim Trockenen Auge die Nervenimpulsaktivität der polymodalen und mechanischen Nozizeptoren und der Kälte-Thermorezeptoren mit hohem Hintergrund und niedriger Schwelle (HB-LT) und niedrigem Hintergrund und hoher Schwelle (LB-HT) erhöhen (+) oder reduzieren (-). Gemeinsam ergeben diese Veränderungen bewusste Wahrnehmungen unterschiedlicher Qualität sowie Veränderungen des Tränenflusses und des spontanen und reflektorischen Lidschlages.
Beim Trockenen Auge treten eindeutig Veränderungen des Tränenfilms auf. Der Mangel an einheitlichen klinischen Parametern in Studien über den Tränenfilm und die relativ begrenzten Kenntnisse über die Struktur des Tränenfilms machen es jedoch schwierig zu verstehen, wie diese Veränderungen auftreten und welche Signifikanz sie für die Pathophysiologie des Trockenen Auges besitzen. Fortschritte in der Fähigkeit, die Biochemie des Tränenfilms zu charakterisieren, könnten zur Identifikation neuer Marker führen, die verwendet werden können, um das Trockene Auge zu diagnostizieren, potenziell vorherzusagen und sogar zu behandeln. Ein ganzheitlicher Ansatz für normalerweise inaktiv und reagieren auf chemische, mechanische und thermische Stimuli. Sie werden durch Entzündungsmediatoren, die während einer Schädigung freigesetzt werden, sensibilisiert. Der Transiente Rezeptor Potential Kationenkanal der Unterfamilie V, Subtyp 1 (TRPV1) ist für die sensorische Übertragung und die Sensibilisierung der polymodalen Nozizeptoren wichtig. Reine Mechanonozizeptoren sind in Ruhe ebenfalls inaktiv und reagieren nur auf mechanische Kräfte, möglicherweise über PIEZO2 und andere noch nicht identifizierte signalübertragende Kanäle. Kälte-Thermorezeptoren geben bei Normaltemperatur kontinuierlich Nervenimpulsentladungen an die Augenoberfläche ab und erhöhen oder reduzieren jeweils die basale Feuerrate bei Abkühlung oder Erwärmung. TRPM8 ist ihr wichtigster übertragender Kanal für Kältesignale und dieser ist auch auf Zunahmen der Osmolarität empfindlich. Die Verdunstung des Tränenfilms zwischen den Lidschlägen verursacht eine diskrete Kühlung der Augenoberfläche und die Osmolarität des Tränenfilms steigt an, dadurch wird die basale Aktivität der Kälte-Thermorezeptoren gesteigert. Dies ist mit der Hypothese konsistent, dass kälteempfindliche Fasern an der Reflexkontrolle der basalen Tränenproduktion und am Lidschlag beteiligt sind.
Die TG-Neurone der Augenoberfläche projizieren primär in zwei räumlich getrennte Regionen innerhalb des Kernkomplexes des Trigeminus im Hirnstamm: die Übergangsregion zwischen kaudalem Vi und Vc (ViVc-Übergang) und an der Verbindung Vc/oberes Halsrückenmark (VcC1-Region). Die Evidenz deutet darauf hin, dass die VcC1-Region eine dominante Rolle bei den sensorisch-diskriminativen Aspekten von okulären Schmerzen spielt. Die ViVc-Übergangsneurone werden durch helles Licht erregt und durch Veränderungen des Feuchtigkeitsstatus der Augenoberfläche aktiviert. Augenneurone am ViVc-Übergang projizieren in die Hirnregionen, die den Tränenfluss (Nucleus salivatorius superior) und den Lidschlag (Nucleus motorius nervi facialis) beeinflussen, sowie in den sensorischen Thalamus. Daher wird angenommen, dass Augenneurone am ViVc-Übergang eine signifikante Rolle bei der Aufrechterhaltung der Homöostase der Augenoberfläche spielen.
Die sekretorische Aktivität der Haupttränendrüse wird durch autonome sympathische und parasympathische Nerven reguliert, deren Aktivität wiederum durch reflektorische Einflüsse von sensorischen Neuronen reguliert wird, die die Augenoberfläche versorgen. Die parasympathische Innervation ist extensiver. Über die neuronale Kontrolle der akzessorischen Tränendrüsen ist sehr wenig bekannt, sie scheint jedoch mit derjenigen der Haupttränendrüse vergleichbar zu sein. Während sich im Bereich um die Meibom-Drüsen Nerven befinden, gibt es keine Studien, die die Rolle von sensorischen oder autonomen Nerven und deren Neurotransmitter bei der Regulation der holokrinen Sekretion der Meibom-Drüsen untersuchen. Die Aktivierung von sensorischen Nerven, die die Kornea bei Ratten versorgen, ruft eine Schleimsekretion der Becherzellen hervor; die an dieser Reflexantwort beteiligten efferenten Nerventypen sind jedoch noch nicht untersucht worden. Verschiedene nicht neurale Prozesse regulieren die Freisetzung von Muzinen aus dem mehrschichtigen Plattenepithel, aber bis heute wurde keine regulatorische Rolle für Nerven oder Neurotransmitter identifiziert.
Zusätzlich zur Regulation der Tränenproduktion sind die Nerven der Augenoberfläche, die Empfindungen vermitteln, am Lidschlagverhalten beteiligt (Abb. 4). Es wird angenommen, dass der spontane Lidschlag zumindest teilweise durch das kontinuierliche Feuern von Nervenimpulsen der Kälte-Thermorezeptoren an der Augenoberfläche aufrechterhalten wird, eine Wirkung, die wahrscheinlich durch die Verbindungen von TG-Neuronen mit Vi/Vc-Neuronen im Hirnstamm vermittelt wird, die wiederum auf die motorischen Neurone des Nervus facialis (VII. Hirnnerv) projizieren. Der sensorische Nozizeptoreninput, der auf Neurone in der VcC1-Region projiziert, initiiert den reflektorischen Lidschlag über die Projektionen auf die ViVc-Übergangsneurone und stellt die Lidschlagamplitude und die maximale Geschwindigkeit des Korneal-Reflex-Lidschlages ein.
Beim Trockenen Auge ist das Hornhautepithel durch eine reduzierte Tränensekretion gegenüber ungünstigen Umweltbedingungen ungeschützt, was häufig zu variablen entzündlichen Veränderungen und zur Schädigung der peripheren Nervenendigungen führt. Eine Entzündung verursacht eine Sensibilisierung der polymodalen Nozizeptoren und der Mechano-Nozizeptoren, während die Aktivität der Kälte-Thermorezeptoren unterdrückt wird. Beim experimentellen Trockenen Auge ist die Sensibilisierung der Nozizeptorfasern jedoch diskret, und die bedeutendste Nervenstörung besteht in der anhaltenden, abnormen Zunahme der Aktivität der Kälte-Thermorezeptoren, die parallel mit den morphologischen Veränderungen der Hornhautinnervation auftritt. Dies deutet darauf hin, dass die durch Trockenheit induzierte Nervenschädigung gegenüber der durch Entzündung induzierten, dominiert und eine abnorme Aktivität vorwiegend in den Kälte-Endigungen verursacht. Parallel zu diesen Veränderungen der peripheren Nervenaktivität zeigen die okulären Neurone des Hirnstamms sowohl in der ViVc- als auch in der VcC1-Region eine verstärkte Reaktionsbereitschaft.