TFOS DEWS II - Pathophysiologie
Anthony J. Bron, FRCOph, FMedSci, Cintia S. de Paiva, MD, PhD1, Sunil K. Chauhan, DVM, PhD1, Stefano Bonini, MD, Eric E. Gabison, MD, Sandeep Jain, MD, Erich Knop, MD, PhD, Maria Markoulli, PhD, MOptom, Yoko Ogawa, MD, Victor Perez, MD, Yuichi Uchino, MD, PhD, Norihiko Yokoi, MD, PhD, Driss Zoukhri, PhD, David A. Sullivan, PhD
German translation sponsored by Allergan
Auf der Grundlage begutachteter Literatur ist der TFOS DEWS II-Unterausschuss für Pathophysiologie zu dem Schluss gekommen, dass der Kernmechanismus des Trockenen Auges, die durch Verdunstung induzierte Hyperosmolarität des Tränenfilms ist, welche das Merkmal dieser Erkrankung ist. Sie schädigt die Augenoberfläche sowohl direkt als auch durch Initiierung einer Entzündung. Der Zyklus der Ereignisse, der als Teufelskreis des Trockenen Auges beschrieben wird, ist in der Mitte von Abb. 2 dargestellt.
Zwei Formen des Trockenen Auges sind anerkannt: das hyposekretorische Trockene Auge und das evaporative Trockene Auge. Beim hyposekretorischen Trockenen Auge kommt es zu einer Hyperosmolarität des Tränenfilms durch eine reduzierte Tränensekretion, bei einer normalen Verdunstung der Tränenflüssigkeit. Beim evaporativen Trockenen Auge wird die Hyperosmolarität durch eine übermäßige Verdunstung des exponierten Tränenfilms, bei Vorliegen einer normal funktionierenden Tränendrüse verursacht. Da die Tränen-Osmolarität als eine Funktion der Tränenverdunstung angesehen wird, die sowohl beim hyposekretorischen Trockenen Auge als auch beim evaporativen Trockenen Auge auftritt, entsteht die Tränen-Hyperosmolarität durch Evaporation von der okulären Oberfläche und in diesem Sinne sind alle Formen des Trockenen Auges evaporativ. Mit anderen Worten, das evaporative Trockene Auge wird exakter als ein hyper-evaporativer Zustand angesehen.
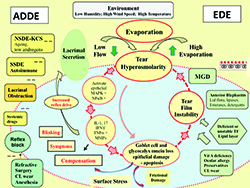
Abb. 2. Pathophysiologie des Trockenen Auges. Eine vollständige Beschreibung dieser Abbildung finden Sie im Originalbericht [7].
Beim Trockenen Auge wird die Tränen-Hyperosmolarität als Trigger einer Kaskade von Signaltransduktionsereignissen innerhalb der Zellen des Oberflächenepithels angesehen, wodurch es zur Freisetzung von Entzündungsmediatoren und Proteasen kommt.
Diese Mediatoren, zusammen mit der Tränen-Hyperosmolarität selber, werden als Verursacher des Verlustes von Becherzellen und Epithelzellen und einer Schädigung der epithelialen Glykokalix angesehen. Entzündungsmediatoren aus aktivierten T-Zellen, die an die Augenoberfläche rekrutiert werden, verstärken die Schädigung. Das Nettoergebnis ist die charakteristische Keratitis superficialis punctata beim Trockenen Auge und eine Tränenfilminstabilität, die irgendwann zu einem vorzeitigen Aufreißen des Tränenfilms führt. Dieses Aufreißen verschlimmert und verstärkt die Tränen-Hyperosmolarität und vervollständigt die Ereignisse des Teufelskreises, der zu einer Schädigung der Augenoberfläche führt. Letztlich wird angenommen, dass dies zur Aufrechterhaltung der Erkrankung führt.
Die Tränenfilminstabilität kann ohne vorheriges Auftreten einer Tränen-Hyperosmolarität initiiert werden, durch Erkrankungen, die die Augenoberfläche beeinflussen, einschließlich Xerophthalmie, okuläre Allergie, Anwendung topischer Konservierungsmittel und das Tragen von Kontaktlinsen. In diesem Fall wird angenommen, dass das vorzeitige Aufreißen des Tränenfilms die primäre Basis für die Hyperosmolarität des Tränenfilms ist, die initial lokal an der Stelle des.
Stelle des Aufreißens auftritt und mit zunehmendem Schweregrad irgendwann in Tränenmeniskusproben nachweisbar wird. Dies stellt eine Augenoberflächen-bezogene Form des evaporativen Trockenen Auges dar. Bei dem MGD-bezogenen evaporativen Trockenen Auge resultiert die Hyperosmolarität aus einer Störung der Lipidschicht des Tränenfilms. Bei dem hyposekretorischen Trockenen Auge kann der Beginn des vorzeitigen Aufreißens während der Entwicklung der Erkrankung des Trockenen Auges sekundär eine evaporative Komponente hinzufügen.
Das hyposekretorische Trockene Auge hat vielfältige Ursachen. Es kann durch eine Blockade der sensorischen Ansteuerung der Tränendrüse entstehen, welche für die Aufrechterhaltung der Tränenfilm-Homöostase essenziell ist. Bilateral verabreichte topische Anästhetika können zu einer Reduktion sowohl der Tränensekretion als auch der Lidschlagfrequenz führen. Ein Trockenes Auge aufgrund einer Blockade der reflektorischen Tränensekretion kann durch den chronischen Missbrauch topischer Anästhetika, einer Schädigung des Nervus trigeminus und durch refraktive Chirurgie einschließlich LASIK-Operation verursacht werden. Die Abgabe von Tränenflüssigkeit in den Tränensack kann auch durch eine Obstruktion der Tränengänge verringert werden, die bei jeder Form einer vernarbenden Bindehauterkrankung auftreten kann, z. B. Trachom, vernarbendes okuläres Pemphigoid, Erythema multiforme, Graft-versus-Host-Erkrankung und Verätzungen. Eine Reihe von Medikamenten, z. B. Antihistaminika, β-Blocker, Spasmolytika, Diuretika und einige Psychopharmaka, können bei systemischer Anwendung eine Reduktion der Tränensekretion verursachen und stellen Risikofaktoren des Trockenen Auges dar [3,8]. Ebenso nimmt die Menge der Tränensekretion mit fortschreitendem Alter ab.
In der westlichen Welt ist die häufigste Ursache des hyposekretorischen Trockenen Auges eine entzündliche Infiltration der Tränendrüse, die beim Trockenen Auge in Verbindung mit Autoimmunerkrankungen wie dem Sjögren-Syndrom am schwerwiegendsten und bei nicht-Sjögren-Syndrom mit einem geringeren Schweregrad beobachtet wird. Die Entzündung verursacht eine Fehlfunktion und/oder Zerstörung sowohl der azinären als auch der duktalen Epithelzellen und einen potenziell reversiblen neurosekretorischen Block. Zirkulierende Antikörper gegen den Muskarinrezeptor (M3) können ebenfalls einen Rezeptorblock verursachen. Niedrige Androgenspiegel im Gewebe können für eine Entzündung der Tränendrüse prädisponierend sein.
Abb. 3. Pathophysiologie der MGD. Eine vollständige Beschreibung dieser Abbildung finden Sie im Originalbericht [7].
Epithelschäden und mangelhafte Glykokalix, sowie ein Verlust des Tränenvolumens und des Muzins der Becherzellen führen zu einer vermehrten reibungsbedingten Schädigung und Symptomen. Die Tränen-Hyperosmolarität und die Epithelschädigung beim Trockenen Auge stimulieren die Nervenenden der Hornhaut, wodurch es zu subjektiven Beschwerden, erhöhter Lidschlagfrequenz und potenziell zu einer kompensatorischen reflektorischen Zunahme der Tränensekretion kommt. Diese kompensatorische Sekretion ist beim evaporativen Trockenen Auge wahrscheinlicher, bei dem die Tränendrüsenfunktion potenziell normal ist.
Ein schematisches Diagramm zur Darstellung der Ätiologie und des Mechanismus der MGD, der Hauptursache des evaporativen Trockenen Auges, ist in Abb. 3 zu finden. Obwohl viele mechanistische Aspekte noch nicht geklärt sind, soll die Abbildung die derzeitige Sichtweise zusammenfassen. Im oberen Teil der Abbildung ist die Ätiologie der beiden MGD-Formen dargestellt, die zu einer geringen Meibom-Drüsen-Sekretion führen, die durch Vernarbung bedingte und die durch nicht-Vernarbung bedingte MGD.
Mit fortschreitendem Alter kommt es zu einer Zunahme des Meibom-Drüsen-Ausfalls, insbesondere nach Erreichen eines Alters von 50 Jahren, was mit dem Auftreten der primären MGD korreliert. Ein Abfall der bioverfügbaren Androgene kann zu diesen Ereignissen beitragen. Im Jugendalter kann die Behandlung von Akne vulgaris mit cis-Retinsäure eine Drüsenatrophie und eine MGD induzieren, während in einer älteren Altersgruppe die Unempfindlichkeit oder Blockade von Androgenrezeptoren die Zeichen der MGD induzieren kann. Die Glaukommedikamente Pilocarpin und Timolol zeigen ebenfalls direkte Wirkungen auf die humanen Epithelzellen der Meibom-Drüsen, die deren Morphologie, Überlebensdauer und/oder proliferative Kapazität beeinflussen und möglicherweise eine MGD fördern können. Polychlorierte Biphenyle können eine systemische Erkrankung verursachen, die MGD-artige Merkmale beinhaltet. Bestimmte Hauterkrankungen wie z. B. Rosazea, atopische Dermatitis, seborrhoische Dermatitis und Psoriasis sind mit der nicht-vernarbenden MGD assoziiert, während vernarbende Erkrankungen der Bindehaut wie Trachom, Erythema multiforme und Pemphigoid zu einer vernarbenden MGD führen.
Ein Hauptereignis bei der nicht-vernarbenden MGD ist die Hyperkeratinisierung der terminalen Ganganteile, die zu einer Obstruktion und Dilatation der Kanäle und zur Inaktivitätsatrophie der Drüsen führt. Später kann es zu einer Obliteration der Drüsenausgänge kommen. Die Obstruktion kann durch Veränderungen der Ölzusammensetzung verschlimmert werden, die die Viskosität des Meibom-Drüsen-Sekrets erhöhen. Der Grad der entzündlichen Veränderungen im Bereich der betroffenen Drüsen variiert in verschiedenen Berichten, aber Entzündungszeichen am Lidrand sind häufig. Entzündungsmediatoren und Lipide können in die Tränenflüssigkeit und an der Augenoberfläche freigesetzt werden und eine Epithelschädigung verursachen. Bei der vernarbenden MGD verzieht die submuköse Vernarbung der Bindehaut die Ausgänge der Meibom-Drüsen, die Ausführungsgänge und die dahinterliegende mukokutane Zone über den posterioren Lidrand hinweg und auf die Tarsalplatte zu, wo die verengten und verschobenen Gänge nicht mehr effektiv Meibom-Drüsen-Sekret in die Lipidschicht des Tränenfilms abgeben können. Die geringe Abgabe von Meibom-Drüsen-Sekret und Veränderungen der Ölzusammensetzung können zu Instabilität des Tränenfilms, vermehrter Verdunstung des Tränenfilms und schließlich zum evaporativen Trockenen Auge führen. Bei MGD mit geringer Meibom-Drüsen-Sekretion können Symptome durch die lokale Erkrankung der Lider selber, durch die Liderkrankung mit Augenoberflächenschädigung und durch ein evaporatives Trockenes Auge entstehen.